1.
Einleitung ^
Die Fälschung von Arzneimitteln und Arzneimittelverpackungen wird zunehmend raffinierter. Dadurch erhöht sich für Patienten das Risiko, mit gefälschten Arzneimitteln in Kontakt zu kommen. Gefälschte Arzneimittel haben im besten Fall keine, im schlechtesten Fall eine tödliche Wirkung.
In den letzten Jahren ist der Umsatz mit gefälschten Arzneimitteln stark angestiegen. Aktuell beträgt der Umsatz mit gefälschten Arzneimitteln schätzungsweise um die 100 Mrd. US-Dollar pro Jahr. Bei einzelnen Arzneimitteln wie etwa Potenzmitteln zur Überwindung erektiler Dysfunktion bei Männern übersteigt der Umsatz, der mit gefälschten Arzneimitteln gemacht wird, jenen der Originale bei weitem.1
Arzneimittelfälschungen stellen Gefährdungen für die Gesundheit, für das Vertrauen in das Funktionieren weitreichender staatlicher Regulierung des Arzneimittelmarkts sowie für die wirtschaftlichen Interessen von Arzneimittelherstellern und -händlern dar.4
Aus diesem Grund hat die Europäische Union im Jahr 2011 eine Richtlinie bezüglich gefälschter Arzneimittel erlassen. Zu dieser Richtlinie ist im Jahr 2016 eine Verordnung der Europäischen Kommission ergangen.5
2.1.
Überblick ^
Die Richtlinie 2011/62/EU6 ist eine Änderungsrichtlinie zur Richtlinie 2001/83/EG zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel und wird im Englischen gewöhnlich mit «Falsified Medicine Directive» abgekürzt. Im Deutschen werden verschiedene Kurztitel verwendet, etwa «Richtlinie über gefälschte Arzneimittel», «Fälschungsrichtlinie», «Anti-Fälschungsrichtlinie» oder «Fälschungsschutzrichtlinie». Die zur Richtlinie gehörige Delegierte Verordnung ist die Verordnung (EU) 2016/161.7
Die Richtlinie enthält verschiedene Maßnahmen zur Erhöhung der Fälschungssicherheit von Humanarzneimitteln. Dies ist zum einen die Pflicht, grundsätzlich alle Verpackungen verschreibungspflichtiger Humanarzneimittel sowie bestimmter nicht-verschreibungspflichtiger Humanarzneimittel, die ein besonderes Fälschungsrisiko bergen, mit Sicherheitsmerkmalen zu versehen.8 Zum anderen werden neue Anforderungen an die Herstellung und den Vertrieb von Humanarzneimitteln gestellt.
2.2.
Maßnahmen zur Erhöhung der Fälschungssicherheit von Arzneimitteln ^
Die neuen Sicherheitsmerkmale, die die Verpackungen verschreibungspflichtiger sowie die Verpackungen bestimmter nicht-verschreibungspflichtiger Humanarzneimittel aufweisen müssen, sind zusammen mit der Schaffung eines Datenspeicher- und -abrufsystems, mit dessen Hilfe eines der Sicherheitsmerkmale überprüft werden soll, die wesentlichsten Änderungen im Vergleich zum Status quo ante.
2.2.1.
Vorrichtung gegen Manipulation ^
Die Richtlinie über gefälschte Arzneimittel verlangt eine Vorrichtung gegen Manipulation (engl. anti-tampering device), um die Unversehrtheit der äußeren Verpackung überprüfen zu können. Ein jegliches Öffnen der Packung muss zu einer sichtbaren, irreversiblen Beschädigung oder Veränderung der Verpackung führen. Bei der Vorrichtung gegen Manipulation handelt sich um einen sog. Erstöffnungsschutz.
Arzneimittel, deren Verpackungen manipuliert worden sind, dürfen nicht in den Verkehr gebracht werden. Sind Arzneimittel, deren Verpackungen manipuliert worden sind, bereits in den Verkehr gebracht worden, so dürfen sie nicht weitergegeben werden, insbesondere dürfen sie nicht an Patienten abgegeben werden.11
Die Überprüfung der Unversehrtheit der äußeren Verpackung anhand der Vorrichtung gegen Manipulation zeigt, ob eine Packung geöffnet oder verändert wurde, seit sie den Hersteller verlassen hat.
Weder die Richtlinie über gefälschte Arzneimittel noch die dazugehörige Delegierte Verordnung geben Auskunft, wie die Vorrichtung gegen Manipulation genau auszusehen hat. Mangels Vorgabe empfiehlt sich die Anwendung der einschlägigen DIN-Norm, DIN EN 16679:2015-03 («Verpackung – Merkmale zur Überprüfung von Manipulationen an Arzneimittelverpackungen»).12 Diese DIN-Norm enthält anschauliche Beispiele für verschiedene technische Lösungen. In der Praxis finden häufig Klebepunkte, spezielle Faltschachtelkonstruktionen sowie Siegellösungen Verwendung.13 Zum Teil können Lösungen miteinander kombiniert werden, was die Arzneimittelsicherheit grundsätzlich erhöht. Jedoch haben Arzneimittelfälscher, was die Druck- und Falttechnik sowie den Erstöffnungsschutz anbelangt, in den letzten Jahren stark aufgeholt, sodass sich bei Verwendung der richtigen Kartonage und der richtigen Druckfarben täuschend echte, nicht nur für den durchschnittlichen Patienten kaum von einer Originalverpackung unterscheidbare Verpackungen herstellen lassen.14
2.2.2.
Serialisierung der Arzneimittelpackungen sowie 2D-Barcode ^
Neben einer Vorrichtung gegen Manipulation verlangt die Richtlinie über gefälschte Arzneimittel ein individuelles Erkennungsmerkmal (engl. unique identifier) auf den Verpackungen verschreibungspflichtiger sowie bestimmter nicht-verschreibungspflichtiger Humanarzneimitteln.
Dies wird durch Serialisierung bewerkstelligt. Serialisierung bedeutet, dass einer Packung eine unverwechselbare Identität gegeben wird. Dazu bekommt jede Packung eine zufällig erzeugte (randomisierte) Seriennummer.15 Durch das Randomisieren mit der Vorgabe, dass die Wahrscheinlichkeit einer Ableitung kleiner als 1 : 10.000 ist16, wird ein Erraten gültiger Nummern erschwert. Dadurch, dass jede Nummer nur einmal vergeben wird, wird jede Arzneimittelpackung zum Unikat und über den 2D-Barcode – dazu sogleich – eindeutig identifizierbar.17
Die zufällig erzeugte Seriennummer wird zusammen mit dem Produktcode, der Chargennummer und dem Ablaufdatum in einem zweidimensionalen Barcode verschlüsselt.18 Bei dem zweidimensionalen Barcode handelt es sich um eine maschinenlesbare Datenmatrix, deren Fehlererkennung und -korrektur derjenigen der Datenmatrix ECC20019 gleichkommt oder über diese hinausgeht.20 Im Gegensatz zu Strichcodes, die nur eine Dimension zur Codierung der Daten benutzen, werden bei Data Matrix Codes zwei Dimensionen benutzt.
Der Data Matrix Code wurde durch die Internationale Organisation for Standardization (ISO) genormt.21 Mit der Normung wurde eine Basis geschaffen, um 2D-Codes hersteller- und lesegerätunabhängig zu generieren. Der Aufbau eines Data Matrix Codes gleicht einem Schachbrett. Jedes einzelne Feld (Matrixzelle) im Datenbereich enthält eine Information. Das Feld ist entweder hell oder dunkel. Je acht Felder werden zu einem Modul, Module zu Datensegmenten zusammengefasst. Zu den Feldern und Modulen kommen Begrenzungslinien («finder patterns»), leere Zonen («quiet zones») sowie Ausrichtungsmuster («allignment patterns»).22 Für die nach der Delegierten Verordnung zu verschlüsselnden Daten ist eine 26 x 26 Matrix in der Regel ausreichend. Gemäß Artikel 7 der Delegierten Verordnung müssen der Produktcode, die (randomisierte) Seriennummer sowie gegebenenfalls die nationale Kostenerstattungsnummer auf der Verpackung im Klartext – also unverschlüsselt als numerische oder alphanumerische Zeichenfolgen – neben dem 2D-Barcode aufgedruckt werden, sofern die Summe der beiden längsten Seiten der Verpackung 10 cm übersteigt.
Die nachstehende Abbildung zeigt eine Musterabbildung für eine Arzneimittelpackung mit einer Vorrichtung gegen Manipulation (anti-tampering device) und individuellem Erkennungsmerkmal (unique identifier).23 
Abbildung 1: Arzneimittelpackung mit Erstöffnungsschutz, 2D-Barcode sowie Klartextinformationen
2.2.3.
Datenspeicher- und -abrufsystem ^
Das Versehen von Verpackungen verschreibungspflichtiger sowie bestimmter nicht-verschreibungspflichtiger Humanarzneimittel mit einer Vorrichtung gegen Manipulation und die Kennzeichnung der Verpackungen mit einem individuellen Erkennungsmerkmal wären im Kampf gegen Arzneimittelfälschung wohl unzureichend, wenn es nicht auch zu einer Überprüfung dieser Sicherheitsmerkmale käme.24
Die Überprüfung der Sicherheitsmerkmale kann eine fortlaufende oder eine solche sein, bei der Arzneimittelpackungen entweder nur an den Schnittstellen – also bei einem Übergang von einer Station zur nächsten – oder ausschließlich zu Beginn und Ende der Lieferkette geprüft werden.25
Die nachstehende Abbildung zeigt mögliche Überprüfungspunkte für das individuelle Erkennungsmerkmal.26 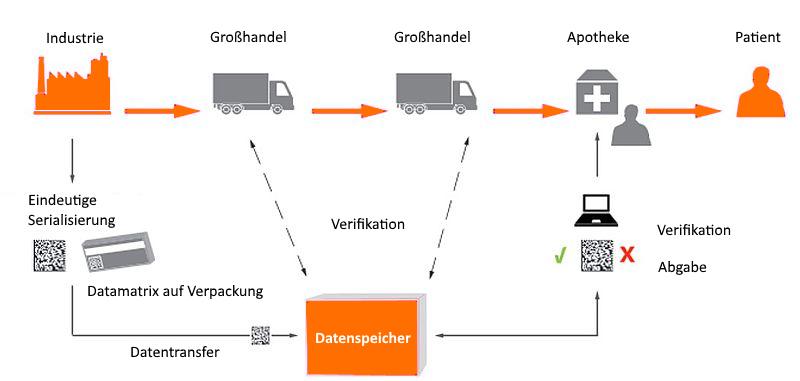
Abbildung 2: Individuelles Erkennungsmerkmal und dessen Überprüfung im Rahmen der legalen Lieferkette
Der Europäische Gesetzgeber hat sich für ein sog. End-to-end-Überprüfungssystem entschieden. Demnach wird das individuelle Erkennungsmerkmal, also die zufällig erzeugte Seriennummer zusammen mit dem Produktcode, der Chargennummer, dem Ablaufdatum und gegebenenfalls der nationalen Kostenerstattungsnummer am Ende des Herstellungsvorgangs in einem Datenspeicher- und -abrufsystem gespeichert. Dies erfolgt durch Scannen des dazugehörigen 2D-Barcodes und dessen Upload in das Datenspeicher- und -abrufsystem. Vor Abgabe des Arzneimittels an den Patienten – zumeist in der Apotheke27 – wird der 2D-Barcode neuerlich gescannt und die Packung «verifiziert», d.h. der gescannte Code wird mit dem Datenbestand des Datenspeicher- und -abrufsystems dahingehend abgeglichen, ob der Code im System hinterlegt, also von einem Hersteller hochgeladen worden ist und noch nicht deaktiviert wurde. Ist dies der Fall, wird davon ausgegangen, dass es sich bei der gescannten Arzneimittelpackung um eine Originalpackung handelt.28
Der Datenabgleich mit dem Datenspeicher- und -abrufsystem erfolgt ausgesprochen rasch. Artikel 35 der Delegierten Verordnung verlangt eine Antwortzeit von weniger als 300 Millisekunden bei mindestens 95 % der Abfragen. Durch diese kurze Antwortzeit soll es zu keiner wesentlichen Zeitverzögerung bei der Abgabe der Arzneimittel kommen. Bei einem positiven Ergebnis wird die Arzneimittelpackung abgegeben und der Code als verbraucht aus dem System ausgebucht, somit deaktiviert. Bei einem negativen Ergebnis (keine hinterlegten Daten im Datenspeicher; Fälschungsverdacht) darf die Arzneimittelpackung nicht abgegeben werden. Zudem ist die zuständige Behörde bei einem negativen Ergebnis unverzüglich zu verständigen.
Das Datenspeicher- und -abrufsystem besteht aus einem zentralen Informations- und Datenrouter («EU-Hub») sowie Datenspeichern für das Hoheitsgebiet eines Mitgliedstaats («nationale Datenspeicher») oder für das Hoheitsgebiet mehrerer Mitgliedstaaten («supranationale Datenspeicher»). Die nationalen und supranationalen Datenspeicher sind mit dem EU-Hub verbunden bzw. über den EU-Hub untereinander.29
Das Datenspeicher- und -abrufsystem ist kein offenes, öffentliches System, sondern nur bestimmten Akteuren zugänglich. An dieses System haben sich die an der legalen Lieferkette Beteiligten – sofern für sie keine Ausnahme besteht – anzuschließen.30 Die Kosten des Systems haben die Hersteller der verschreibungspflichtigen Arzneimittel und jener nicht-verschreibungspflichtigen Arzneimittel, die ein individuelles Erkennungsmerkmal aufweisen und deren Codes hochgeladen worden sind, zu tragen.31 Mit Ausnahme einiger weniger Mitgliedstaaten musste das System europaweit ab 9.2.2019 einsatzbereit sein.32
3.
Umsetzung und erste Praxiserfahrungen ^
Den für das Datenspeicher- und -abrufsystem erforderlichen EU-Hub hat die im Jahr 2015 gegründete European Medicines Verification Organisation, kurz: EMVO, eingerichtet. Die Zeitpunkte, zu denen sich die Betreiber der nationalen Datenspeicher dem EU-Hub angeschlossen haben, können bei den Meldungen unter https://emvo-medicines.eu/news-events/ eingesehen werden.
Mitglieder der EMVO sind die Europäischen Verbände der Pharmazeutischen Industrie, des Pharmagroßhandels, der Apotheker und der Parallelhändler von Arzneimitteln.33
Zur Errichtung und zum Betrieb der nationalen Datenspeicher sind eigene Betreiber vorgesehen. In Österreich wurde hierfür Ende 2016 die Austrian Medicines Verification Organisation als Verein gegründet. Dieser Verein hat eine 100%ige Tochtergesellschaft, die AMVS GmbH, welche als Betreiber des österreichischen Datenspeichers fungiert. Der Anschluss an den EU-Hub erfolgte im Juni 2018.34 Technischer Dienstleister der AMVS GmbH ist arvato Bertelsmann. In Deutschland ist die securPharm e.V. für den nationalen Datenspeicher zuständig. Anders als in Österreich wird in Deutschland mit zwei Datenbanken gearbeitet. Eine Datenbank erfasst die pharmazeutischen Unternehmen, die andere die Apotheken, Krankenhausapotheken und Arzneimittelgroßhändler. Den Betrieb der beiden Datenbank(teil)systeme hat die securPharm e.V. zwei Betreibern übertragen. Technischer Dienstleister ist einmal arvato Bertelsmann, das andere Mal die Deutsche Telekom AG.
Aufgrund von Anlaufschwierigkeiten wurden in Österreich zunächst die ersten sechs Monate nach dem 9.2.2019 als Stabilisierungsphase genutzt. Während dieser Phase wurden Fehlermeldungen aus dem nationalen Datenspeicher- und -abfragesystem eigens gekennzeichnet und nicht zwingend für Fälschungsverdachtsmeldungen gehalten.35 Die Stabilisierungsphase ermöglichte eine Abgabe der Arzneimitteln trotz Warnmeldung. Während dieser sechs Monate wurde ersichtlich, dass Arzneimittelpackungscodes z.T. noch fehlerhaft hochgeladen werden sowie Apotheker, die bei Abgabe mehrerer Packungen ein- und desselben Arzneimittels bislang einfach eine Packung mehrfach gescannt haben, sich erst daran gewöhnen müssen, jede einzelne Packung zu scannen. Aus diesem Grund wurde die Stabilisierungsphase bis 9.2.2020 verlängert.36 Die Fehlermeldungen, die das System anzeigt, gehen konstant zurück (unbekannte Seriennummer, unbekannter Produktcode, unbekannte Chargennummer, überschrittenes Ablaufdatum). Sie liegen in Österreich bei unter 10.000 monatlich bei mehr als 3,8 Mio. gescannten Arzneimittelpackungen und damit prozentual unter dem EU-Durchschnitt.37
4.
Zusammenfassung / Schlussbemerkung ^
Die Europäischen Union ist sich der Risiken, die von gefälschten Arzneimitteln ausgehen, bewusst. Mit der Richtlinie über gefälschte Arzneimittel, RL 2011/62/EU, und der dazu ergangenen Delegierten Verordnung (EU) 2016/161 sind entsprechende Rechtsvorschriften für verschreibungspflichtige und für bestimmte nicht-verschreibungspflichtige Humanarzneimittel geschaffen worden.
Neben der Vorrichtung gegen Manipulation (anti-tampering device) ist als zweites Sicherheitsmerkmal ein individuelles Erkennungsmerkmal (unique identifier) auf den Verpackungen dieser Arzneimittel vorgesehen. Dieses zweite Sicherheitsmerkmal hat nur dann einen Sinn, wenn es ebenfalls überprüft wird – und zwar elektronisch. Die elektronische Überprüfung erfolgt im Rahmen einer End-to-end-Überprüfung. In einem ersten Schritt wird, bevor eine Arzneimittelpackung in die legale Lieferkette gelangt, ein 2D-Barcode für diese Arzneimittelpackung generiert und die in dem 2D-Barcode enthaltenen Daten in einem Datenspeicher- und -abfragesystem hinterlegt. In einem zweiten Schritt wird – als Prüfung im engeren Sinne – die Packung vor der Abgabe des Arzneimittels an den Patienten «verifiziert», d.h. der 2D-Barcode auf der Arzneimittelpackung wird gescannt und mit dem Datenbestand des Datenspeicher- und -abrufsystems abgeglichen.
Der 2D-Barcode von Humanarzneimitteln kann als ein Beispiel für Digitalisierung, genauer: als ein Beispiel für verantwortungsvolle Digitalisierung gesehen werden.
5.
Literatur ^
- Dungl, Christoph/Achrainer, Andreas, Serialisierung von Arzneispezialitäten – Praxisfragen und Umsetzung in Österreich, JMG 2019, S. 7–15.
- Focke, Jürgen, Serialisierung, Track & Trace pharmazeutischer Produkte: Lösungsszenarien für IT und Produktion, in: Stienecker, Frank/Wesch, Martin W. (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 202–211.
- Hellbert, Carina, Handbuch Pharmarecht, Wien: LexisNexis ARD Orac, 2013.
- Lampka, Nadine, Fälschungsschutz-Technologien für Arzneimittel: Ein Überblick, in: Stieneker, Frank/Wesch, Martin W. (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 68–76.
- Liebenwein, Stefanie, Verantwortlichkeiten in der Vertriebskette, RdM-Ö&G 2016, S. 27–33.
- Meyer, Hilko J., Die Umsetzung der Fälschungsrichtlinie in der Krankenhausversorgung, A&R 2019, S. 3–8.
- Redeker, Frank, Maßnahmen gegen Arzneimittelfälschungen entlang der Wertschöpfungskette, in: Stienecker/Wesch (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 180–191.
- Reindl-Krauskopf, Susanne, Arzneimittelfälschung, RdM 2014, S. 14–17.
- Rist, Benjamin, Fälschungsschutz in der Pharmabranche – Lösungen aus der Verpackungsbranche, in: Stieneker, Frank/Wesch, Martin W. (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 173–179.
- Sinn, Arndt, Organisierte Kriminalität 3.0, Berlin; Heidelberg: Springer, 2016.
- Sinn, Arndt/Berg, Michael, Das Europäische Sicherheitslogo für Online-Apotheken und die Maßnahmen zur Absicherung der legalen Arzneimittellieferkette, in: Sinn, Arndt et al. (Hrsg.): Auswirkungen der Liberalisierung des Internethandels in Europa auf die Arzneimittelkriminalität, Berlin; Heidelberg: Springer, 2019, S. 265–276.
- Steiner, Theresia/Tieben, Helga, Serialisierung von Arzneimitteln – ein europäisches Projekt, RdM-Ö&G 2016, S. 14–17.
- Sträter, Burkhard, Arzneimittelfälschungen. Maßnahmen der Gesetzgeber in der Europäischen Union und in Deutschland, Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, 2017, S. 1188–1195.
- Weigelt, Wilfried/Anhalt, Erhard, Codierung von Arzneimittelverpackungen zum Schutz vor Fälschungen. Detailinformationen zum System der Codierungen und zum Data Matrix Code, in: Stienecker, Frank/Wesch, Martin W. (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 77–168.
- 1 Dazu Hellbert, Pharmarecht Handbuch, Wien: LexisNexis ARD Orac, 2013, S. 262.
- 2 Auf die diesbezüglich hohe kriminelle Energie hinweisend Sinn, Organisierte Kriminalität 3.0, Berlin; Heidelberg: Springer, 2016, S. 55: «Gefälschte Arzneimittel wie auch Zigaretten sind das neue Kokain».
- 3 Patienten erhalten Arzneimittel, die sie benötigen, regelmäßig nicht direkt vom Hersteller. Die Hersteller geben ihre Arzneimittel an den Pharmahandel ab. Dieser wiederum beliefert Apotheken und Krankenhäuser. In diesem Zusammenhang bestehen strenge rechtliche Vorgaben für die einzelnen an der Lieferkette Beteiligten (vgl. Liebenwein, Verantwortlichkeiten in der Vertriebskette, RdM-Ö&G 2016, S. 29 ff).
- 4 Vgl. Reindl-Krauskopf, Arzneimittelfälschung, RdM 2014, S. 15 sowie Dungl/Achrainer, Serialisierung von Arzneispezialitäten – Praxisfragen und Umsetzung in Österreich, JMG 2019, S. 7.
- 5 Dazu Steiner/Tieben, Serialisierung von Arzneimitteln – ein europäisches Projekt, RdM-Ö&G 2016, S. 14 ff.
- 6 Richtlinie 2011/62/EU des Europäischen Parlaments und des Rates vom 8. Juni 2011 zur Änderung der Richtlinie 2001/83/EG zur Schaffung eines Gemeinschaftskodexes für Humanarzneimittel hinsichtlich der Verhinderung des Eindringens von gefälschten Arzneimitteln in die legale Lieferkette, Amtsblatt der Europäischen Union v. 1.7.2011, ABl. L 174/74.
- 7 Delegierte Verordnung (EU) 2016/161 der Kommission vom 2. Oktober 2015 zur Ergänzung der Richtlinie 2001/83/EG des Europäischen Parlaments und des Rates durch die Festlegung genauer Bestimmungen über die Sicherheitsmerkmale auf der Verpackung von Humanarzneimitteln, Amtsblatt der Europäischen Union v. 9.2.2016, ABl. L 32/1.
- 8 Verpackungen verschreibungspflichtiger Humanarzneimittel müssen die Sicherheitsmerkale aufweisen, es sei denn ein verschreibungspflichtiges Humanarzneimittel wäre ausnahmsweise ausgenommen, weil es in einer Befreiungsliste (White List) aufgeführt ist. Verpackungen nicht-verschreibungspflichtiger Humanarzneimittel müssen die Sicherheitsmerkmale grundsätzlich nicht aufweisen, es sei denn, ein nicht-verschreibungspflichtiges Humanarzneimittel wäre in eine Black List aufgenommen. Die Listen sind Anhänge zur Delegierten Verordnung (EU) 2016/161.
- 9 Dazu Sinn/Berg, Das Europäische Sicherheitslogo für Online-Apotheken und die Maßnahmen zur Absicherung der legalen Arzneimittellieferkette, in: Sinn et. al. (Hrsg.), Auswirkungen der Liberalisierung des Internethandels in Europa auf die Arzneimittelkriminalität, Berlin; Heidelberg: Springer, 2019, S. 265 ff.
- 10 Hellbert, a.a.O. [FN 1], S. 265.
- 11 Auch wenn die Richtlinie eine Vorrichtung gegen Manipulation nur für Verpackungen bestimmter Arzneimittel vorschreibt, empfiehlt sich eine derartige Vorrichtung bei sämtlichen Arzneimittelverpackungen. Europarechtlich ist dies zulässig («Die Mitgliedstaaten können die Anwendung der in Artikel 54 Buchstabe o genannten Vorrichtung gegen Manipulation für die Zwecke der Sicherheit der Patienten auf andere Arzneimittel ausdehnen» – Artikel 54a Absatz 5 Satz 3 der Richtlinie 2001/83/EG i.d.F. der Richtlinie über gefälschte Arzneimittel). In Österreich ist es nach der VO BGBl. II Nr. 41/2019 Arzneimittelherstellern erlaubt, die Vorrichtung gegen Manipulation auch auf Verpackungen von Arzneimitteln anzubringen, die nach dem Europarecht keine entsprechenden Sicherheitsmerkmale aufweisen müssen.
- 12 Vgl. Lampka, Fälschungsschutz-Technologien für Arzneimittel: Ein Überblick, in: Stienecker/Wesch (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 75 sowie Sträter, Arzneimittelfälschungen. Maßnahmen der Gesetzgeber in der Europäischen Union und in Deutschland, Bundesgesundheitsblatt – Gesundheitsforschung – Gesundheitsschutz, 2017, S. 1190.
- 13 So Lampka, a.a.O. [FN 12], die bei einem Hersteller von Arzneimittelverpackungen arbeitet.
- 14 Vgl. Sinn/Berg, a.a.O. [FN 9], S. 272.
- 15 Eine Begriffsklärung liefert Focke, Serialisierung, Track & Trace pharmazeutischer Produkte: Lösungsszenarien für IT und Produktion, in: Stienecker/Wesch (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 203.
- 16 So Artikel 4 Buchstabe c der Delegierten Verordnung.
- 17 Eine weitere Möglichkeit der Individualisierung wäre das Versehen der Arzneimittelpackungen mit Radio Frequency Identification Chips, kurz: RFID Chips. RFID Chips sind aktuell noch vergleichsweise teuer. Zudem arbeiten die hierfür erforderlichen Lesegeräte langsamer als herkömmliche Barcode-Scanner (vgl. Weigelt/Anhalt, Codierung von Arzneimittelverpackungen zum Schutz vor Fälschungen. Detailinformationen zum System der Codierungen und zum Data Matrix Code, in: Stienecker/Wesch (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 139).
- 18 Gemäß Artikel 4 Buchstabe b der Delegierten Verordnung können die Mitgliedstaaten der Europäischen Union vorsehen, dass zum Zwecke der Abrechnung auch die nationale Kostenerstattungsnummer mit verschlüsselt wird.
- 19 Ein in den 1980er-Jahren in den USA entwickelter 2D-Code, der in der Praxis große Bedeutung erlangt hat.
- 20 Vgl. Artikel 5 Absatz 2 der Delegierten Verordnung.
- 21 ISO/IEC 16022:2006.
- 22 Zu den Eigenschaften des Data Matrix Codes ausführlich Weigelt/Anhalt, a.a.O. [FN 17], S. 129 ff.
- 23 Abbildung entnommen https://ec.europa.eu/commission/presscorner/detail/de/MEMO_19_802 (13.12.2019).
- 24 So handelt es sich beim individuellen Erkennungsmerkmal zunächst einmal nur um irgendeinen Packungsaufdruck.
- 25 Dazu, vielleicht etwas zu kurz in der Darstellung Redeker, Maßnahmen gegen Arzneimittelfälschungen entlang der Wertschöpfungskette, in: Stienecker/Wesch (Hrsg.): Schutz vor Arzneimittelfälschungen. Regelungen zur Arzneimittelsicherheit – Technische Umsetzung – Ausblick, Aulendorf: Editio Cantor Verlag, 2018, S. 184 f.
- 26 Quelle: Herba Chemosan Apotheker-AG.
- 27 Zu den Besonderheiten der Arzneimittelabgabe an/in Krankenanstalten und zu den Herausforderungen der Prüfung der Sicherheitsmerkmale anlässlich dieser siehe Meyer, Die Umsetzung der Fälschungsrichtlinie in der Krankhausversorgung, A&R 2019, S. 33ff sowie Dungl/Achrainer, a.a.O. [FN 4], S. 11 ff.
- 28 Bei dieser Methode der Verifizierung wird in Kauf genommen, dass die erste Packung eines gefälschten Arzneimittels mit einer «richtigen» Nummer zunächst unerkannt bleibt, wenn es vor dem Original verifiziert wird. Jede weitere Packung eines gefälschten Arzneimittels mit derselben Nummer – wie auch das Original selbst – fällt hingegen auf (so bereits Weigelt/Anhalt, a.a.O. [FN 17], S. 80).
- 29 Vgl. Steiner/Tieben, a.a.O. [FN 5], S. 15.
- 30 Vgl. Dungl/Achrainer, a.a.O. [FN 4], S. 9.
- 31 Artikel 54a Absatz 2 Buchstabe e der RL 2001/83/EG i.d.F. der Richtlinie über gefälschte Arzneimittel; gleichlautend Artikel 31 Absatz 5 der Delegierten Verordnung.
- 32 Belgien, Griechenland und Italien. Für diese Länder gibt es längere Fristen, da diese Länder bereits über eigene Überprüfungssysteme für Arzneimittel verfügen (dazu Sinn/Berg, a.a.O. [FN 9], S. 273).
- 33 Dies entspricht den Vorgaben für die Einrichtung des Datenspeicher- und -abrufsystems in Artikel 31 der Delgierten Verordnung.
- 34 Dazu siehe https://emvo-medicines.eu/news/announcement-one-additional-country-connected-to-the-eu-hub-5/ (13.12.2019).
- 35 Vgl. Dungl/Achrainer, a.a.O. [FN 4], S. 14 f.
- 36 Eine weitere – letzte – Verlängerung der Stabilisierungsphase ist zum Zeitpunkt der Fertigstellung dieses Beitrags im Gespräch (20.12.2019).
- 37 Daten liefern die wöchentlichen EMVO Monitoring Reports.





